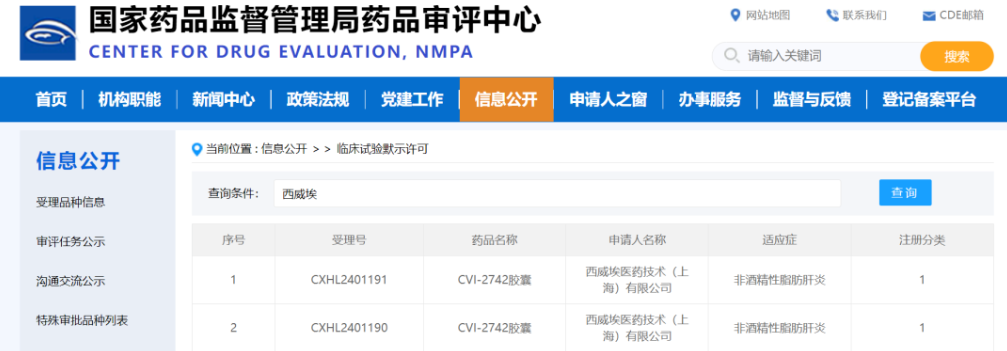
1月13日,西威埃醫藥技術(上海)有限公司(以下簡稱“西威埃醫藥”)申請藥品“CVI-2742膠囊”,獲得臨床試驗默示許可。“CVI-2742膠囊”是以肝臟甲狀腺激素受體β(THR-β)為靶點的化學小分子新藥,適應癥為非酒精性脂肪肝炎(NASH)。有濟醫藥在該項目中承擔了非臨床安全性評價服務,以高效、專業、合規的技術服務,高質量完成項目交付,助力CVI-2742膠囊順利獲得NMPA臨床許可。有濟醫藥向西威埃醫藥致以誠摯的祝賀,期待CVI-2742膠囊早日為我國的非酒精性脂肪肝炎患者提供更多治療選擇,改善生活質量!
藥物安全性評價是新藥研發中不可或缺的一環,有濟醫藥非臨床安全性評價平臺可以承接各種藥物類型的一般毒理、安全藥理、生殖毒理、遺傳毒理、毒代動力學和制劑安全性等全方位的安評技術服務。平臺建立了基于FDA和NMPA GLP規范的藥物安全性評價質量管理體系,針對不同類型的新藥設計針對性的非臨床試驗方案,試驗設計遵從NMPA、FDA、ICH等國內/國際指導原則,試驗實施全流程嚴格遵守GLP法規的要求,保障實驗結果的真實性、準確性以及可溯源性,確保客戶的每一個項目都能高質量的、合規的交付。
關于非酒精性脂肪性肝炎(NASH)
非酒精性脂肪性肝炎(NASH)是一種在沒有過量飲酒的情況下,肝臟中出現脂肪堆積并伴隨炎癥的肝病。它是非酒精性脂肪性肝病(NAFLD)的一種嚴重類型。當肝臟中超過5%的肝細胞發生脂肪變性,并伴隨著小葉內炎癥和肝細胞氣球樣變性時,就被診斷為NASH。NASH是一種嚴重的肝病,如果不及時治療,可能會發展為肝硬化。據相關統計顯示,單純性脂肪肝患者隨訪2010年肝硬化發生率僅有0.6%~3.0%,而NASH患者2015年內肝硬化發生率高達15%~25%。此外,患者合并高齡、肥胖、高血壓、2型糖尿病、代謝綜合征等,均可增加肝硬化的發生風險。
關于西威埃醫藥
西威埃醫藥(CVI Pharmaceuticals Shanghai Limited,下稱CVI)是一家處于臨床研究階段的專注于心血管和肝臟代謝疾病創新藥物研發的制藥公司,在美國加州和上海設有現代化的研發中心, 藥物臨床前開發和臨床研究管理團隊。CVI研發的第一個候選藥物是first-in-class化學1.1 類口服小分子降血脂創新藥CVI-LM001,世界上首個進入臨床II期研究階段的口服小分子PCSK9抑制劑。CVI研發的第二個候選藥物 CVI-2742是化學1類口服小分子治療非酒精性脂肪肝炎(NASH)的創新藥。CVI的管理團隊由專門擁有針對NASH和高脂血癥新藥多年藥學研究及臨床開發經驗的制藥行業專業人士,在脂質代謝方面具有強大研究背景的學術科學家以及在血脂異常治療方面擁有廣泛專業知識的臨床醫生組成。管理團隊具有豐富的經驗和較高的權威性,擁有從侯選化合物篩選, 產品開發到臨床實驗及新藥獲批的完整經驗。公司的顧問團隊是由國際著名心血管疾病研究領域學術領頭人和在國外國內大型藥企NASH和心血管疾病領域創新藥臨床試驗的負責人,以及著名臨床醫生組成。